
人体无细胞血管(The human acellular vessel,HAV)是一种由Humacyte公司利用再生医学技术开发的创新型生物血管。HAV来源于在生物反应器中循环脉动扩张过程培养的人体血管平滑肌细胞,在经过去细胞化处理后,保留了完整的血管结构、具有抗拉强度和耐久性,同时去除了免疫原性成分,最终由细胞外基质组成。
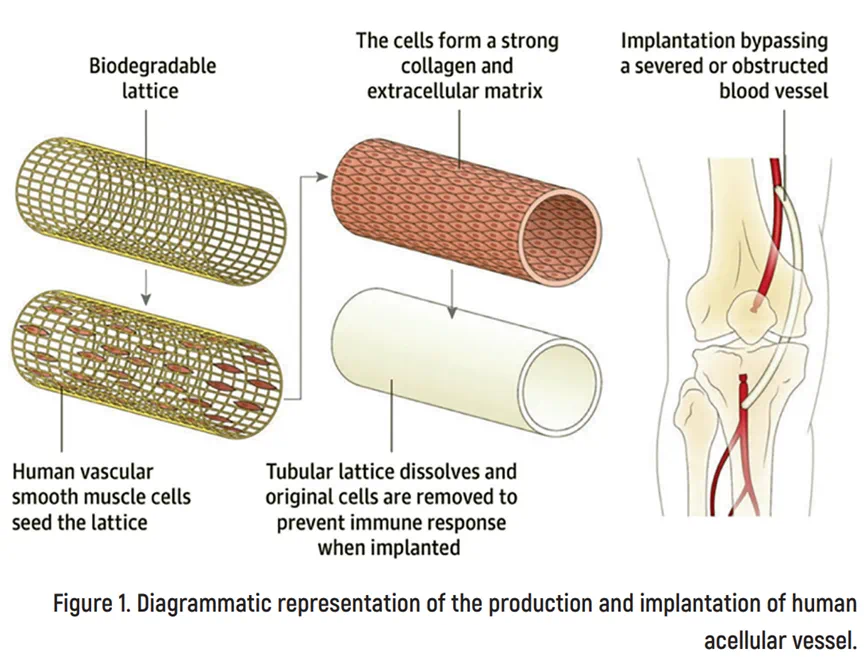
在植入人体以后,HAV能够被受体的免疫细胞、上皮细胞和肌源性细胞逐渐填充,有利于血流动力学和免疫的适应性,并有可能重塑为功能性的三层血管。HAV现已商品化,可现成供应(目前提供6毫米直径、40厘米长的血管),并冷藏保存(4–8°C),在使用前可在室温下存放长达48小时,无需解冻。现有证据表明,植入后无需特殊的抗凝或免疫抑制治疗。
BEST-CLI研究进一步强调了使用高质量自体导管进行旁路手术在改善慢性肢体威胁性缺血(CLTI)患者肢体保留中的重要作用。Farber等人在该研究中发现,对于拥有理想大隐静脉的CLTI患者,旁路手术与较少的主要不良肢体事件相关性比血管内介入治疗更低。然而,在需要下肢血运重建的患者中,适合的静脉材料缺乏的比例高达40%,特别是在重复手术的患者中。合成移植物的表现不佳,通畅率较低,并且在组织丧失或坏疽的情况下容易感染。作为一种现成的生物制品,HAV有可能将旁路手术的肢体保留优势扩展到没有适合自体静脉的患者身上。更广泛地说,像HAV这样的现成生物制品的可用性,在当今血管手术越来越关注新型导管介入技术的背景下,扩展了开放式旁路手术作为治疗选择的可能性。
自2021年以来,梅奥诊所血管和血管内手术部门与美国食品药品监督管理局(FDA)及Humacyte公司合作,开展了一项关于HAV作为下肢缺血患者旁路器材的前瞻性研究。在FDA的监督下,自2021年3月以来,已有35例患有严重缺血、既往干预失败且没有合适静脉移植物的患者使用了HAV进行治疗。这项由医生发起的新药临床研究协议已实施三年,涵盖了100%的患者,结果显示HAV具有良好的安全性和疗效。尽管在这群患有晚期疾病、远端靶点不佳且血流受限的患者中,HAV在12个月时的初级通畅率仅为38%,但它在重新干预后表现出更好的次级通畅率(65%),使得74%的病例避免了截肢。
作为多学科护理计划的一部分,使用HAV进行旁路手术延长了基于术前创伤、缺血和足部感染(WIfI)分类的肢体保留预期。梅奥诊所的经验为患者和外科医生提供了宝贵的见解,并为HAV在疾病严重程度较轻且没有自体移植物选择的患者中设计的三期临床研究提供了参考。


