主动脉根部瘤是一种可能危及生命的疾病,可能导致主动脉破裂,通常与遗传综合征有关,例如马凡氏综合征(MFS)。尽管MFS动物模型的研究为主动脉根部瘤的发病机制提供了有价值的见解,但对人类主动脉根组织转录组学和表观遗传图谱的理解仍不充分,这种限制阻碍了有效靶向药物的研发。 近日,中国医学科学院阜外医院周洲、舒畅、罗明尧主任团队与北京大学医学部王凯团队合作在顶级期刊Advanced Science(影响因子:15.1,Q1区)在线发表题为“Single-Nucleus Multiomic Analyses Identifies Gene Regulatory Dynamics of Phenotypic Modulation in Human Aneurysmal Aortic Root”的研究论文。中国医学科学院阜外医院副研究员刘宣雨和博士生曾晴怡为本文共同第一作者。本研究构建了首个人类健康和MFS条件下主动脉根部组织中的基因表达和染色质可及性的单细胞核多组学图谱。该研究为人类主动脉根部平滑肌细胞表型调节过程中的转录调控和空间动态变化提供了新的见解。 文章简介
英文题目:Single-Nucleus Multiomic Analyses Identifies Gene Regulatory Dynamics of Phenotypic Modulation in Human Aneurysmal Aortic Root
中文题目:单核多组学分析揭示人主动脉根部瘤表型调节过程中的基因调控动态变化
发表单位:中国医学科学院阜外医院、北京大学基础医学院
发表时间:2024.03
发表期刊:Advanced Science
影响因子:15.1
研究对象:MFS患者(n=6)的动脉瘤主动脉根组织;心脏移植受者CTRL(n=6)的正常主动脉根组织
组学类型:10X Genomics Chromium snRNA-seq+scATAC-seq(每组n=4),10X Visium Spatial (每组n=2)
研究思路
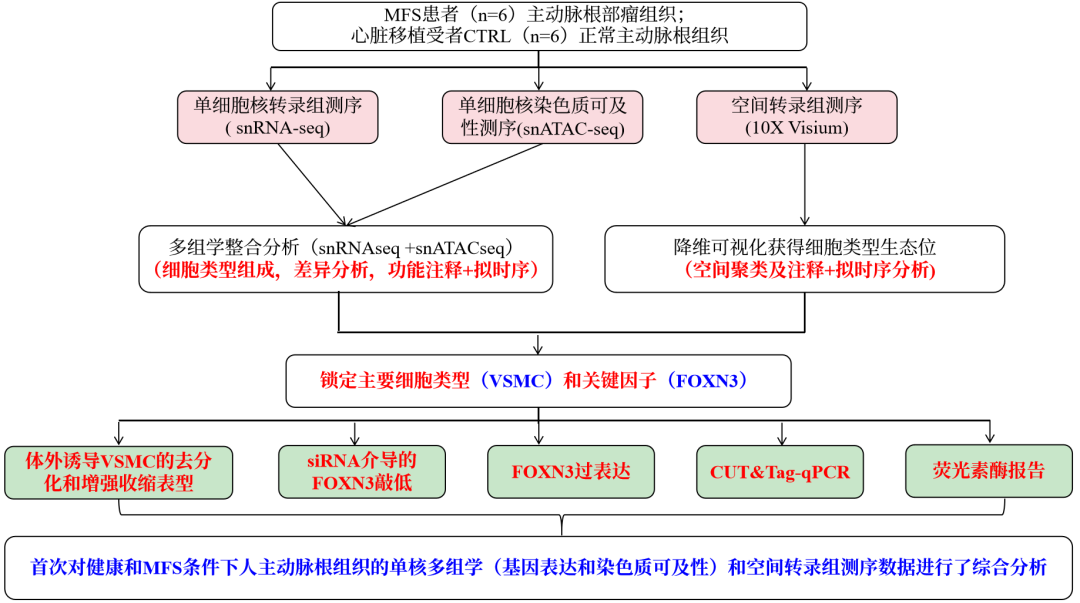
主要结果
1、健康和MFS条件下人主动脉根部组织中的细胞类型特异性表达模式和基因调控模式
所有细胞核的无监督聚类能够识别主动脉中的主要的细胞类型,包括血管平滑肌细胞(VSMC)、成纤维细胞(FB)、壁细胞(Mural)、血管内皮细胞(VEC)、淋巴内皮细胞(LEC)、脂肪细胞(Adipocyte)、髓样细胞(Myeloid)和淋巴样细胞(Lymphoid)。值得注意的是,VSMC占所有细胞核的76.9%,这与人主动脉的预期细胞组成一致。VSMC可进一步细分为三个子亚群。利用单核多组学数据,鉴定了人主动脉根部的细胞类型特异性表达模式和基因调控模式。并鉴定出在每个细胞类群中特异性的顺式调控元件(cCRE)富集的转录因子(TF)结合基序。利用peak功能注释软件GREAT推断细胞类型特异性cCRE的功能富集。
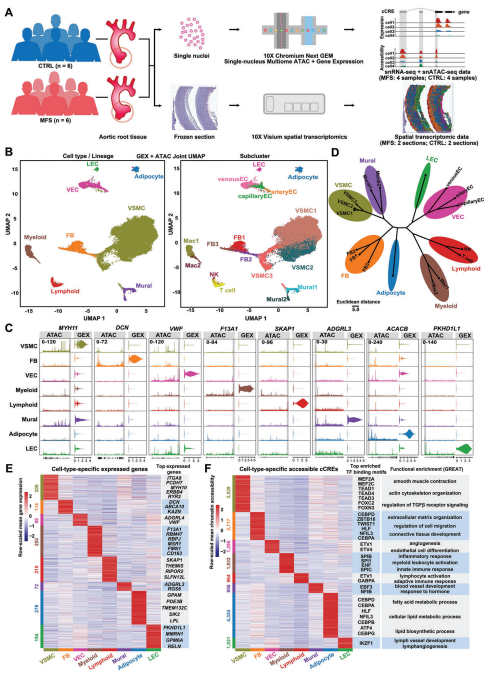
图1 健康和MFS条件下人主动脉根部组织中的细胞类型特异性表达模式和基因调控模式。
2、与对照组相比,MFS的细胞组成变化和细胞类型特异性调控变化
两组在细胞类型组成方面表现出高度的整体相似性,这一发现与之前关于升主动脉瘤的单核研究一致。尽管如此,与对照组相比,VSMC2(VSMC亚群)在MFS样本中占比显著升高,反映了其与MFS的关联。两组之间的细胞组成没有明显差异,但基因表达和染色质可及性有显著差异,特别是在VSMC中,检测到活性显著变化的TF结合基序。GO功能富集分析表明在MFS条件下,VSMCs中上调的DEGs富集了与VSMC去分化或表型转换相关的功能,如脉管系统发育、细胞分化的正调控、细胞外基质重塑和TGFβ受体信号通路,DA cCREs富集基本与DEGs一致。GSEA富集分析结果显示在MFS条件下发现了VSMC中上调的信号通路,如NOTCH3、RhoGTP酶、ROBO受体、TGFβ受体复合物和受体酪氨酸激酶信号通路。
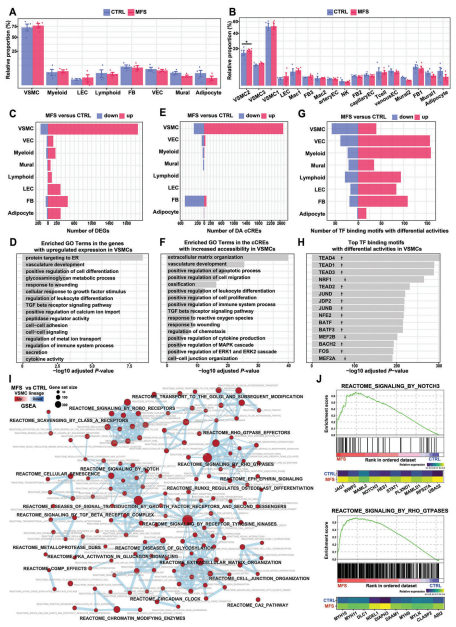
图2 通过单核多组学分析揭示的MFS与CTRL样品中的细胞组成改变和细胞类型特异性调控变化
3、人主动脉根部VSMC表型调节过程中的基因表达和基因调控动态变化
单核数据分析使我们能够揭示高可塑性VSMC的表达模式,包括三个亚型。VSMC1表达高水平的RYR2,其编码与VSMC的收缩性相关的细胞内Ca2+释放通道和ACTA2和CNN1等典型收缩标志物。这些发现表明VSMC1代表一种收缩性VSMC表型。VSMC2表达了高水平的调控VSMC的特征基因,如COL8A1和SERPINE1。值得注意的是,VSMC3还表达了调节VSMC的特征基因(例如COL8A1),但具有与VSMC2不同的表达谱(例如,LAMA2和CFH的高表达水平)。对来自MFS患者的主动脉根组织的公开单细胞数据集的重新分析也支持VSMC3代表了VSMC而不是成纤维细胞的特殊状态。VSMC的拟时序分析揭示了VSMC1和VSMC3可能代表发育分化的两个极端。通过单分子荧光原位杂交(smFISH),确认了这两个亚群s人主动脉根组织中存在的,并在空间分布上表现出差异:RYR2高VSMC1细胞主要位于靠近外膜的培养基中,而CFH高表达的VSMC3细胞优先位于靠近内膜的培养基中。正如预期的那样,在MFS与CTRL条件下,VSMC1细胞的相对比例降低,而VSMC2细胞的比例增加。此外,通过鉴定其表达或可及性随拟时间而变化的基因或cCRE,揭示了VSMC表型调节过程中的基因表达和染色质可及性动态变化。这些基因或cCREs的功能富集分析揭示了VSMCs的表型调节,从收缩表型到增殖和迁移增加的合成表型。收缩表型标志物(例如,RYR2和MYH11)的表达随着分化轨迹逐渐降低,而调节合成表型的标志物(例如COL8A1,SERPINE1和TNFRSF11B)的表达增加。值得注意的是,一些TF基因,如FOXN3、BACH1、BACH2和TEAD1,在分化轨迹上动态表达,反映了它们在表型转换中的潜在作用。同样,我们还确定了随分化轨迹动态变化的cCRE。例如,基因间cCRE的可及性(chr11:12552464-12553207)与TEAD1的表达呈正相关,表明该调节因子可能是增强子。
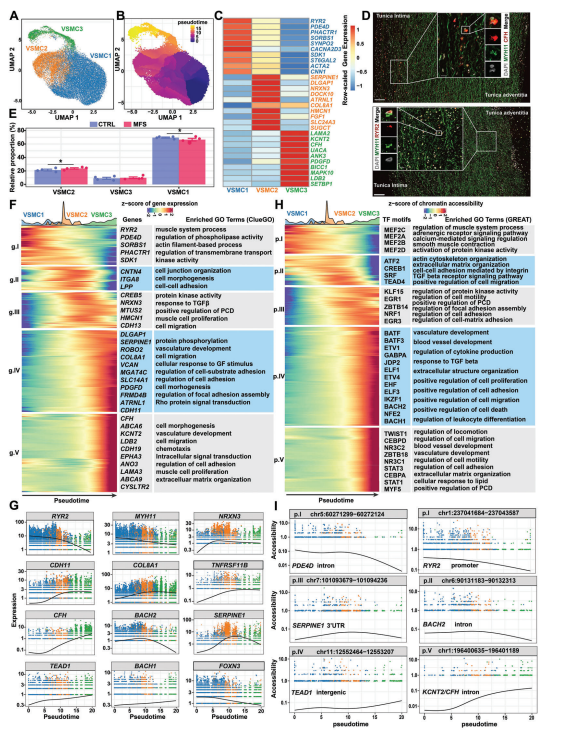
图3 人主动脉根部VSMC表型调节过程中的基因表达和基因调控动态变化
4、驱动VSMC表型调节和主动脉根部瘤发病机制的潜在关键调节因子
为了确定驱动VSMC表型调节的潜在关键调节因子,进行了单细胞加权基因共表达网络分析(scWGCNA)。在VSMC中鉴定出9个基因共表达模块。通过比较不同条件的模块表达评分,检测到两个主要模块在MFS中表达显著改变:模块M7在MFS条件下的表达评分明显低于CTRL条件,而模块M9在MFS中的表达评分显著升高。UMAP投影中的表达分布表明,表达模块M7的VSMC通常与VSMC1重叠,表达模块M9的VSMC通常与VSMC2和VSMC3重叠。与此一致,M7的Hub基因包括收缩性VSMC的标记物(例如PDE4D和RYR2),而M9的Hub基因包括调节VSMC的标记物。值得注意的是,M7和M9的核心TF包括在拟时序分析动态表达的TF,例如BACH2、FOXN3和TEAD1。综上所述,确定了与VSMC的收缩或调节表型相关的基因共表达模块。
接下来,通过整合多个分析结果,包括TF基因表达、调节子(TF及其预测靶标)表达活性和TF结合基序活性的显著差异,以及拟时序分析结果,优先考虑驱动VSMC表型调节的潜在关键调节因子。共获得11个TFs,包括TGFβ通路相关调节因子(SMAD3和TWIST1)、应激响应调节因子(FOS、JUN和JUNB)、BACH家族调节因子(BACH1和BACH2)、钙化(RUNX2)和其他(TEAD1、FOXN3和CREB1)。TEAD1是先前报道的VSMC收缩基因表达抑制因子,在候选关键调节因子列表中,并得到多项证据的支持。值得注意的是,主要在收缩性VSMC中表达的FOXN3是唯一在MFS和CTRL条件下表达和调节活性显著降低的调节因子。染色质可及性数据显示,与CTRL组相比,MFS组VSMC中FOXN3的表现出更高的染色质可及性。Westernblot测定证实,MFS患者主动脉根组织培养基中FOXN3的蛋白水平显著降低。FOXN3调节子的功能富集表明,FOXN3可能靶向与收缩力、VSMC表型调节和主动脉瘤发病机制相关的重要通路,例如“血管平滑肌收缩”、“肌动蛋白细胞骨架调节”和“黏着斑”。总之,我们的数据揭示了潜在的关键调节因子,例如FOXN3,它们可能驱动VSMC的表型调节和主动脉根部瘤的发病机制。
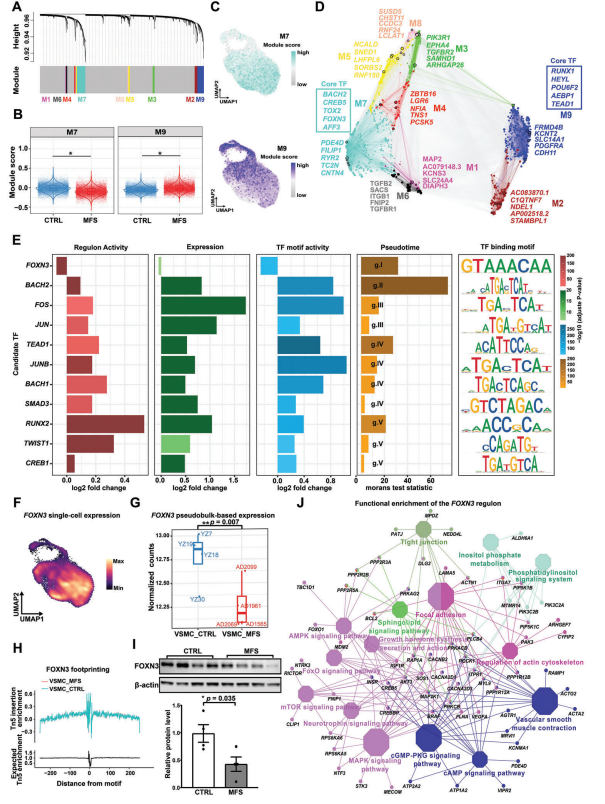
图4 可能驱动VSMC表型调节和主动脉根部瘤发病机制的潜在关键调节因子
5、空间转录组显示人主动脉根部中膜区域的VSMC的空间表达模式
由于机械负荷和细胞微环境等因素的差异,VSMC可能在主动脉壁上表现出表型差异。通过空间聚类及注释确定了9个空间spot集,并根据其表达特征注释细胞类型。值得注意的是,注释为VSMC的spot集位在UMAP聚类图中,形成了从高度收缩性VSMC(SC4)到未调节收缩性VSMC(SC0)再到调节VSMC(SC1)的表型变化的分布。这些spot集在中膜切片上显示出从外层(外侧)到内层(内膜侧)呈径向分布。单根据单细胞转录组数据注释,确认三个VSMC亚型在组织切片上的空间分布,收缩亚团簇VSMC1主要位于中膜的外层,而调节亚团簇VSMC2和VSMC3主要位于内层。拟时序分析结果表明对VSMC空间点(SC4、SC0和SC1),从外层(未调节收缩性)到内层(收缩性),这也代表了VSMC表型调节过程中的表达动态。调节性VSMC不仅与疾病状态有关,而且与空间位置有关。

图5 空间转录组显示人主动脉根部中膜区域的VSMC的空间表达模式
6、FOXN3可作为维持人主动脉VSMC收缩表型的关键调节因子
研究继续对候选关键调节因子FOXN3在人主动脉平滑肌细胞(HASMC)中的功能作用进行体外验证。结果表明FOXN3的表达与HASMCs的收缩性呈正相关。接下来,进行FOXN3敲低,收缩标志物的蛋白水平和mRNA表达显著降低以及HASMC的收缩性显著降低。此外,FOXN3敲低显著增加了多边形细胞(即调节的VSMC和Ki-67阳性细胞(即增殖细胞)的占比,表明FOXN3的敲低促进了HASMC的表型调节走向去分化表型。此外,对bulk RNA-seq数据的分析显示,FOXN3敲低后下调的基因在与肌肉收缩相关的功能中显著富集。FOXN3过表达实验发现,收缩标志物的蛋白水平和mRNA表达显著增加,并且收缩力显著增强。多边形细胞和Ki-67阳性细胞的占比显著降低,表明FOXN3的过表达增强了HASMCs的收缩表型。此外,实验证据表明,FOXN3过表达减弱了PDGF-BB刺激诱导的HASMCs的表型调节。
ACTA2不仅是收缩性VSMCs的标志物,而且是VSMCs收缩功能的关键组成部分,ACTA2的突变会导致家族性胸主动脉瘤和主动脉夹层。我们的单核数据支持ACTA2可能是FOXN3的靶标。为了验证这一点,在HASMC中使用FOXN3抗体进行了CUT&Tag-qPCR。FOXN3抗体显著富集了ACTA2启动子片段,而用作阴性对照的IgG没有表现出特异性扩增。此外,ACTA2启动子片段的富集在FOXN3过表达后进一步增加。这些结果证明了FOXN3与HASMC中ACTA2启动子的结合。此外,荧光素酶报告基因测定表明,FOXN3浓度与ACTA2启动子的活性正相关,表明FOXN3对ACTA2启动子的活性具有调节作用。总之,这些结果表明,FOXN3可能通过靶向ACTA2启动子作为维持人主动脉VSMC收缩表型的关键调节因子,因此可以作为治疗主动脉瘤的潜在靶点。
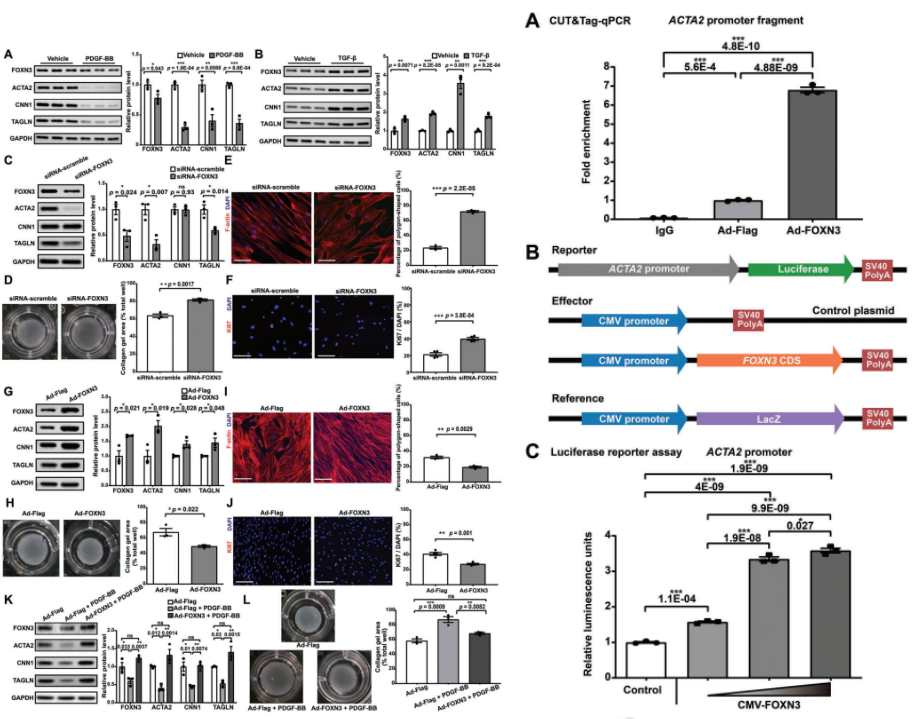
图6 FOXN3可作为维持人主动脉VSMC收缩表型的关键调节因子
参考文献.


